
技術(shù)文章
Technical articles 熱門搜索:
AFMSRCE美國(guó)PINE旋轉(zhuǎn)圓盤電極裝置(中國(guó)區(qū)總代理)
AF01WV10美國(guó)PINE旋轉(zhuǎn)圓盤電極裝置(中國(guó)代理)
MSR-RRDE旋轉(zhuǎn)圓盤電極裝置(RRDE)
美國(guó)pine旋轉(zhuǎn)環(huán)盤電極裝置
Wavedriver美國(guó)PINE旋轉(zhuǎn)圓盤圓環(huán)環(huán)盤電極裝置(總代)
MSR美國(guó)PINE旋轉(zhuǎn)環(huán)盤電極
AFE6MB美國(guó)PINE旋轉(zhuǎn)圓盤電極旋轉(zhuǎn)桿(中國(guó)總代)
美國(guó)pine旋轉(zhuǎn)圓盤環(huán)盤電極裝置中國(guó)區(qū)總代理
旋轉(zhuǎn)圓盤電極RDE
RRDE旋轉(zhuǎn)環(huán)盤電極
MSR旋轉(zhuǎn)圓盤圓環(huán)電極裝置
AFE6R2GCPT美國(guó)PINE旋轉(zhuǎn)圓盤圓環(huán)環(huán)盤電極
AFE7R9GCPT美國(guó)PINE旋轉(zhuǎn)圓盤圓環(huán)環(huán)盤電極-RRDE
旋轉(zhuǎn)圓盤電極裝置(AFMSRCE)
MSR旋轉(zhuǎn)圓盤電極裝置
AFE5TO50AG美國(guó)pine旋轉(zhuǎn)圓盤環(huán)盤電極裝置銀盤
熱門搜索:
AFMSRCE美國(guó)PINE旋轉(zhuǎn)圓盤電極裝置(中國(guó)區(qū)總代理)
AF01WV10美國(guó)PINE旋轉(zhuǎn)圓盤電極裝置(中國(guó)代理)
MSR-RRDE旋轉(zhuǎn)圓盤電極裝置(RRDE)
美國(guó)pine旋轉(zhuǎn)環(huán)盤電極裝置
Wavedriver美國(guó)PINE旋轉(zhuǎn)圓盤圓環(huán)環(huán)盤電極裝置(總代)
MSR美國(guó)PINE旋轉(zhuǎn)環(huán)盤電極
AFE6MB美國(guó)PINE旋轉(zhuǎn)圓盤電極旋轉(zhuǎn)桿(中國(guó)總代)
美國(guó)pine旋轉(zhuǎn)圓盤環(huán)盤電極裝置中國(guó)區(qū)總代理
旋轉(zhuǎn)圓盤電極RDE
RRDE旋轉(zhuǎn)環(huán)盤電極
MSR旋轉(zhuǎn)圓盤圓環(huán)電極裝置
AFE6R2GCPT美國(guó)PINE旋轉(zhuǎn)圓盤圓環(huán)環(huán)盤電極
AFE7R9GCPT美國(guó)PINE旋轉(zhuǎn)圓盤圓環(huán)環(huán)盤電極-RRDE
旋轉(zhuǎn)圓盤電極裝置(AFMSRCE)
MSR旋轉(zhuǎn)圓盤電極裝置
AFE5TO50AG美國(guó)pine旋轉(zhuǎn)圓盤環(huán)盤電極裝置銀盤
 更新時(shí)間:2025-07-23
更新時(shí)間:2025-07-23 點(diǎn)擊次數(shù):458
點(diǎn)擊次數(shù):458
如何測(cè)試轉(zhuǎn)移電子數(shù)
一、 旋轉(zhuǎn)圓盤電極(RDE)法:Koutecky-Levich(K-L)方程
通過(guò)不同轉(zhuǎn)速下的極化曲線,利用K-L方程計(jì)算電子轉(zhuǎn)移數(shù):
步驟:
1.測(cè)量極化曲線:在多個(gè)轉(zhuǎn)速(如400、900、1600、2500 rpm)下記錄ORR極化曲線(j vs.RHE)。
2.提取電流密度:在固定電位下(如0.5 V vs.RHE),從各轉(zhuǎn)速曲線中提取電流密度j。
K-L方程:

其中:
j:實(shí)測(cè)電流密度(mA/cm2)
jk:動(dòng)力學(xué)電流密度
ω:電極轉(zhuǎn)速(rad/s,需將rpm轉(zhuǎn)換為rad/s:×2π/60)
B:Levich斜率,與電子轉(zhuǎn)移數(shù) *n* 相關(guān):
![]()
F:法拉第常數(shù)(96485 C/mol)
D_:O?在溶液中的擴(kuò)散系數(shù)(~1.9×10?? cm2/s,0.1 M KOH)
ν:溶液動(dòng)力粘度(~0.01 cm2/s)
C_{O_2}:溶解O?濃度(~1.2×10?? mol/cm3,25℃)
4. 擬合直線:
繪制 j?1vs.ω?1/2的直線,斜率=B?1。
計(jì)算電子轉(zhuǎn)移數(shù)n:
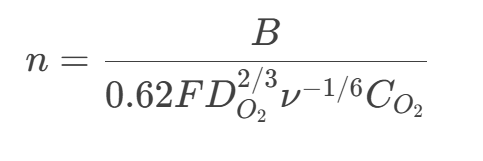
5. 通過(guò)K-L方程算出來(lái)轉(zhuǎn)移電子數(shù)大于4是什么原因:
如果使用K-L方程計(jì)算n值大于4時(shí)可考慮以下幾種原因:
(1) K-L方程里面有很多經(jīng)驗(yàn)常數(shù)值,比如氧氣溶解度、電解液粘度系數(shù)、擴(kuò)散系數(shù)等,這些數(shù)值與實(shí)際測(cè)試可能有偏差;
(2) K-L方程的使用是有前提條件的,比如層流狀態(tài)、比如催化劑要薄,實(shí)際情況可能不是;
(3) 催化劑本身性質(zhì)的影響,如果催化劑在還原區(qū)間存在明顯的背景電流,但處理數(shù)據(jù)時(shí)沒(méi)有扣除,可能會(huì)影響KL曲線斜率,進(jìn)而影響計(jì)算出的n值。比如碳材料,電容電流比較大,降低掃速,扣除背景;
(4) 可能計(jì)算出的n值大于4是"真的",因?yàn)槌薕RR反應(yīng)外,還存在額外反應(yīng)干擾,也貢獻(xiàn)了電子轉(zhuǎn)移。
(5) 電子轉(zhuǎn)移數(shù)一般還是依靠RRDE計(jì)算會(huì)相對(duì)準(zhǔn)確,可見文獻(xiàn)(DOI:10.1021/acscatal.6b01581)
二、 旋轉(zhuǎn)環(huán)盤電極(RRDE)法:直接測(cè)量H2O2產(chǎn)率
通過(guò)盤電極(電流ID)和環(huán)電極(電流IR)計(jì)算n和H2O2產(chǎn)率:
步驟:
1. 測(cè)量ID和IR:在相同電位下記錄盤和環(huán)電流。
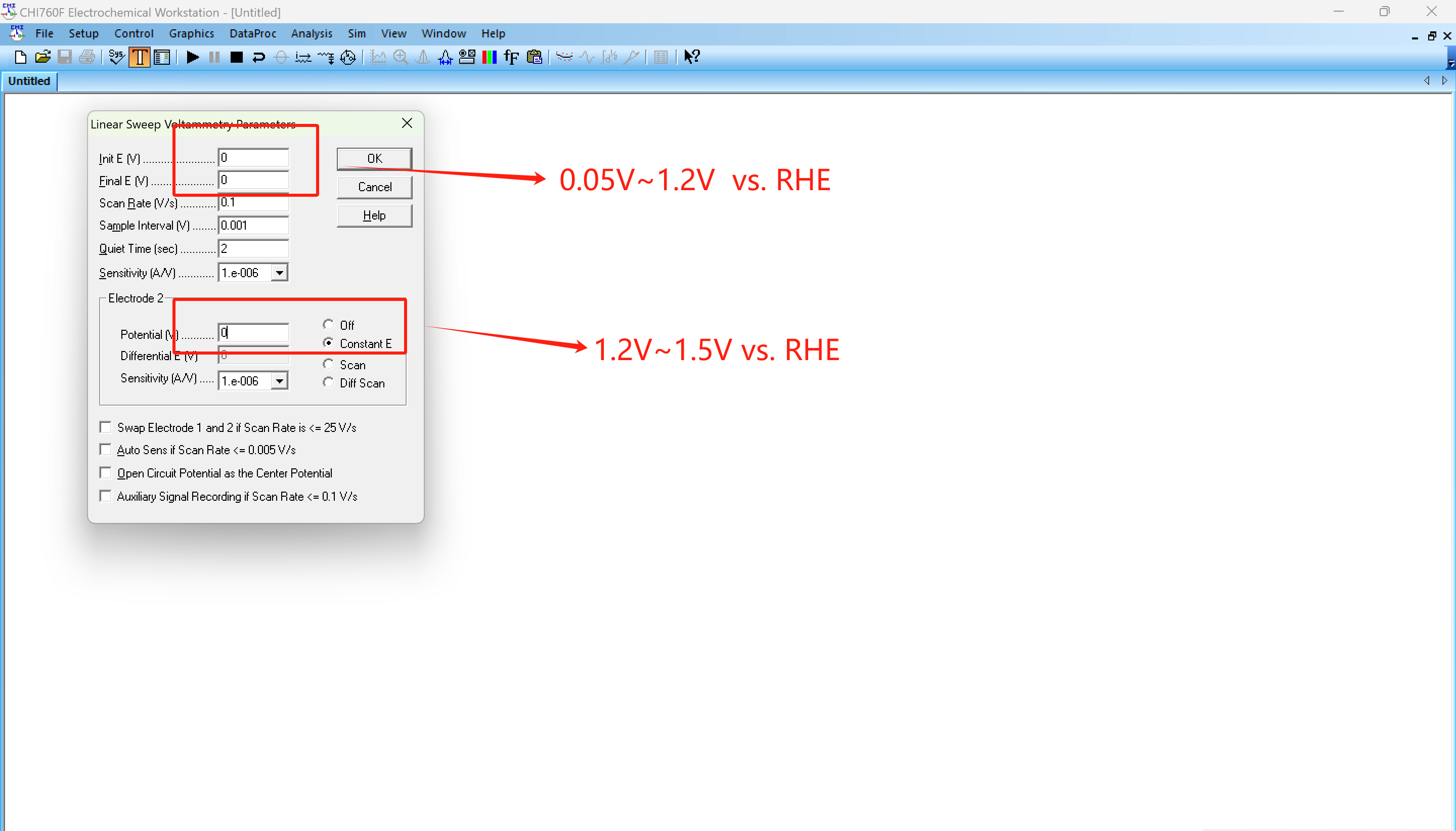
盤上設(shè)置電壓區(qū)間,環(huán)上選擇Constant E恒電壓測(cè)試方法,環(huán)上設(shè)置的恒電壓氧化中間產(chǎn)物過(guò)氧化氫,而不產(chǎn)生其他反映。
H2O2產(chǎn)率(%):
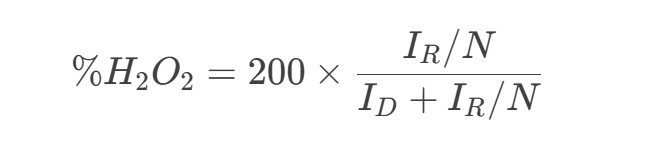
N:環(huán)電極的收集效率(美國(guó)Pine旋轉(zhuǎn)環(huán)盤電極(AFE7R9GCPT)收集系數(shù)為0.37)。
電子轉(zhuǎn)移數(shù)n:
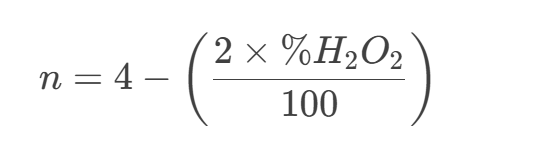
若H2O2產(chǎn)率為0%,則n=4(wanquan4電子路徑生成H2O);
若H2O2產(chǎn)率為100%,則n=2(2電子路徑生成H2O2)。